Reactivos
Bromo:
FORMULA: Br2
PESO MOLECULAR: 159.8 g/mol
GENERALIDADES:
El bromo es un líquido café-rojizo que despide vapores del mismo color. Es el único de los no metales que es líquido bajo condiciones estándar. Es un oxidante poderoso, corrosivo de metales y tejidos, por lo que es muy tóxico. Es más denso que el agua y poco soluble en ella.
Punto de ebullición (°C): 58.8 (760 mm de Hg), 41 (400 mm de Hg), 24.3 (200 mm de Hg), 9.3 (100
mm Hg), 78.8 (2 atm), 110.3 (5 atm), 139.8 (10 atm), 174 (20 atm) y 243.5
(60 atm).
Densidad (g/ml): 3.1396 (15 °C); 3.1226 (20 °C); 3.1055 (25 °C) y 3.0879 (30 °C)
Indice de refracción: 1.6083 (20 °C) y 1.6475 (25°C)
Solubilidad: 1g se disuelve en aproximadamente 30 ml de agua y se incrementa con la presencia de cloruros y bromuros debido a la formación de iones complejos. El contenido de bromo en disoluciones acuosas saturadas es (en g/100 ml de disolución):
3.6 (10 °C), 3.41 (20 °C), 3.35 (25 °C), 3.33 (40°C).
Es miscible con alcohol, éter, disulfuro de carbono, cloroformo, tetracloruro de carbono, y HCl concentrado. Puede reaccionar con algunos disolventes bajo ciertas condiciones.
NIVELES DE TOXICIDAD:
RQ:1
TPQ: 500
LDLo(oral en humanos): 14 mg/kg.
LCLo(por inhalación en humanos): 1000 ppm.
LC50 (por inhalación en ratones): 750 ppm/9 min
México: CPT: 0.7 mg/m3 (0.1 ppm) CCT: 2 mg/m3 (0.3 ppm)
Permanganato de Potasio:
FORMULA: KMnO4
COMPOSICION: K: 24.74 %; Mn: 34.76 % y O: 40.50 %.
PESO MOLECULAR: 158.03 g/mol
GENERALIDADES:
El permanganato de potasio es un sólido cristalino púrpura, soluble en agua. Es no inflamable, sin embargo, acelera la combustión de materiales inflamables y si este material se encuentra dividido finamente, puede producirse una explosión.
Punto de fusión: se descompone a 240 °C con evolución de oxígeno.
Densidad (a 25 °C): 2.703 g/ml
Solubilidad: Soluble en 14.2 partes de agua fría y 3.5 de agua hirviendo. También es soluble en ácido acético,
ácido trifluoro acético, anhidrido acético, acetona, piridina, benzonitrilo y sulfolano.
NIVELES DE TOXICIDAD:
RQ: 100
LDLo (oral en humanos):143 mg/Kg
LD50 (oral en ratas): 1090 mg/Kg
México: CPT: 5 mg/m3 (como Mn)
Nitrato de Plata:
Nombre Comercial :Nitrato de plata
Sinónimos : Piedra infernal
Formula Química : AgNO3
Peso Molecular : 169.87 g/mol
Identificación de Riesgos: Provoca quemaduras en la piel.
Irritación de las vías respiratorias, irritación de la piel,
Irritación de los ojos.
– Inhalación : Podría causar: irritación grave del sistema respiratorio
– Contacto con los ojos y piel : Causa quemaduras. Los compuestos de plata puede causar
decoloraciones grises de los ojos y la piel.
– Ingestión : Tóxico Podría causar: dolor abdominal gastroenteritis
muerte. Afecta el Sistema nervioso central
Tipo de inflamabilidad : No inflamable
Productos peligrosos de la combustión : Humos tóxicos de: óxidos de nitrógeno
Prevención : Este material no es combustible. En el fuego, su
descomposición térmica puede generar gases irritantes y
tóxicos en extremo. Oxidante poderoso. Su contacto con
materiales combustibles puede causar fuego.
Medios de extinción de incendios : Como con todo fuego, use respiradores autóctonos con
demanda de presión y ropa protectora completa. Evacúe el
área, y combata el fuego desde una distancia prudente.
Protección en caso de incendio : Protección de la piel observando una distancia de
seguridad, y usando ropa protectora adecuada.
Riesgos específicos : No Combustible
Productos
Acetileno:
Peso molecular 26,04 g/mol Punto de ebullición (10 psig) -75,00 °C
Densidad del sólido (1 atm) 729,00 kg/m3
Presión crítica 62,50 bara
Densidad gas (15°C, 1 atm) 1,11 kg/m3
Temperatura crítica – 36,00 °C
El Acetileno es un gas incoloro e inodoro en su estado puro, comercialmente tiene un olor característico (ajo). Es ligeramente más liviano que el aire.
– La proporción de contenido de carbono e hidrógeno (elementos componentes) es de aproximadamente 12/1 en peso (7,74% de hidrógeno y 92,96% de carbono). No es tóxico ni corrosivo. Es muy inflamable y arde en el aire con una intensa llama luminosa, humeante y caliente.
Los límites superior e inferior de inflamabilidad son 2,8 y 93% en volumen de Acetileno en aire
– Debido a su inestabilidad a altas presiones, se envasa en cilindros de acero que contienen un relleno monolítico de alta porosidad, saturado con un solvente, que generalmente es acetona, en la que se encuentra disuelto el acetileno, salvo una pequeña proporción, que permanece en estado gaseoso en la parte superior del cilindro. El relleno poroso estabiliza el gas, sofocando los conatos de
descomposición.
Fuentes:
http://www.quimica.unam.mx/IMG/pdf/16bromo.pdf
http://portales.puj.edu.co/doc-quimica/FDS-LabQca-DianaHermith/AgNO3.pdf
http://www.quimica.unam.mx/IMG/pdf/15permanganatok.pdf
http://www.messergroup.com/pe/Archivos_PDF/Gases/Ficha_tecnica_acetileno.pdf






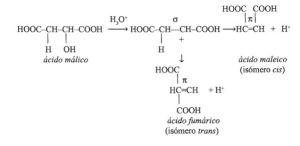 El ácido maleico y el ácido fumárico normalmente no se pueden interconvertir porque la rotación alrededor de un doble enlace carbono-carbono no es energéticamente favorable. En el laboratorio, la conversión del isómero cis en el isómero trans es posible mediante la aplicación de la luz y una pequeña cantidad de bromo. Convierte la luz bromo elemental en un bromo radical, que ataca al alqueno en una reacción de adición de radicales a un bromo-alcano radical, y ahora la rotación de enlace simple es posible. Los radicales se recombinan y el ácido fumárico se forma. En otro método (utilizado como una demostración de clase), el ácido maleico se transforma en ácido fumárico, a través del proceso de calentamiento de la solución de ácido maleico en 12 M de ácido clorhídrico. Además la reacción es reversible (H+) lleva a la rotación libre alrededor del enlace (C-C) central y la formación de ácido fumárico, el más estable y menos soluble. En la industria, el ácido fumárico se produce también a partir del ácido maleico por isomerización catalítica con ácidos minerales, bromatos, o tiourea. Una vez más la gran diferencia en la solubilidad en agua hace que la purificación del ácido fumárico sea fácil.El ácido maleico es una materia prima industrial para la producción de ácido glioxílico por ozonólisis.
El ácido maleico y el ácido fumárico normalmente no se pueden interconvertir porque la rotación alrededor de un doble enlace carbono-carbono no es energéticamente favorable. En el laboratorio, la conversión del isómero cis en el isómero trans es posible mediante la aplicación de la luz y una pequeña cantidad de bromo. Convierte la luz bromo elemental en un bromo radical, que ataca al alqueno en una reacción de adición de radicales a un bromo-alcano radical, y ahora la rotación de enlace simple es posible. Los radicales se recombinan y el ácido fumárico se forma. En otro método (utilizado como una demostración de clase), el ácido maleico se transforma en ácido fumárico, a través del proceso de calentamiento de la solución de ácido maleico en 12 M de ácido clorhídrico. Además la reacción es reversible (H+) lleva a la rotación libre alrededor del enlace (C-C) central y la formación de ácido fumárico, el más estable y menos soluble. En la industria, el ácido fumárico se produce también a partir del ácido maleico por isomerización catalítica con ácidos minerales, bromatos, o tiourea. Una vez más la gran diferencia en la solubilidad en agua hace que la purificación del ácido fumárico sea fácil.El ácido maleico es una materia prima industrial para la producción de ácido glioxílico por ozonólisis.